Die Wirkstoff-Post

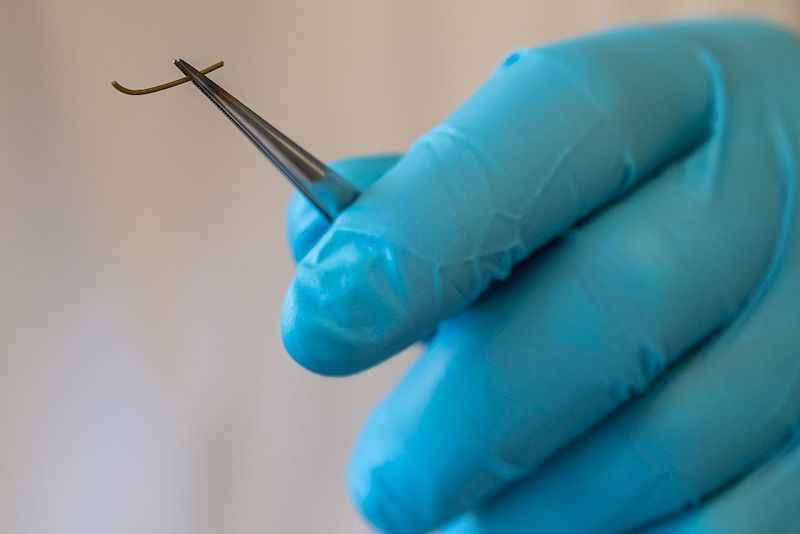
Etwa 400 Nanometer sind die einzelnen Fasern stark und damit 200 Mal dünner als ein menschliches Haar. Am Institut für Pharmazie lässt Doktorand Benedikt Göttel eine Lösung durch eine Nadel fließen und legt dabei eine äußere elektrische Spannung an. „Durch die Spannung wird der Tropfen, der sich an der Nadel bildet, zu einem dünnen Faden verjüngt. Dieser wird dabei getrocknet und aufgefangen“, erklärt Göttel. Electrospinning nennt sich die Methode zur Herstellung dieser Fasern, die in der Pharmazie stark im Kommen ist. In diesem Fall wird sie eingesetzt, um Augeninfektionen wesentlich effizienter als bisher behandeln zu können.
Auf der Platte unter der Nadel bildet sich langsam ein Vlies, das optisch einem Papiertaschentuch ähnelt. Die Lösung, aus der Göttel seine Fasern spinnt, besteht aus verschiedenen Polymeren und einem Wirkstoff: Amphotericin B. Er dient zur Behandlung von Pilzerkrankungen im Auge und ist eigentlich eine gute Sache, denn er greift die Zellmembran von Pilzen sehr spezifisch an. Und trotzdem, sagt der Pharmazeut, ist Amphotericin B ein Problemarzneistoff. „Er löst sich weder in Öl noch in Wasser gut.“ Um ihn aufzulösen, wird der Wirkstoff bisher mit Hilfsstoffen wie Gallensalzen kombiniert, die hinsichtlich ihrer Verträglichkeit nicht unproblematisch sind. Während der Behandlung muss die Arzneilösung zudem einmal pro Stunde ins Auge getropft werden, weil sie über den Tränenkanal und den Lidschlag zu schnell abtransportiert wird.
„Gemeinsam versuchen wir, das zu optimieren“, sagt Göttel. Das Vlies, das er in der Arbeitsgruppe von Prof. Dr. Karsten Mäder am Institut für Pharmazie entwickelt, soll in der Therapie auf das kranke Auge gelegt werden. Dafür hat Göttel aus bereits im Handel verfügbaren Polymeren das Vlies gesponnen und auch den Arzneistoff mit einem ungiftigen Polymer verknüpft, um ihn wasserlöslich zu machen. Damit werden die schädlichen Nebenwirkungen auf die Augenzellen minimiert. Das Vlies wird in Form einer Kontaktlinse gebracht. Im Auge bildet sich aus den Fasern durch den Kontakt mit Tränenflüssigkeit eine gelartige Substanz, die nicht so schnell im Tränenkanal verschwindet.
Zielgenaue Wirkung, kontrollierte Freisetzung, weniger Nebenwirkungen: Forschung zu diesem Themenkomplex ist das Fachgebiet der Arbeitsgruppe Pharmazeutische Technologie von Karsten Mäder, der auch Direktor des Instituts für Pharmazie ist. „Manche Marktprodukte haben unbefriedigende Eigenschaften“, sagt er. Seine Mitarbeiterinnen und Mitarbeiter arbeiten daher oft daran, Wirkstoffe, die bereits medizinisch genutzt werden, für den Transport im menschlichen Körper besser zu verpacken und an ihren Wirkort zu bringen. Sein Team kooperiert hierbei sehr eng mit Medizinern aus dem Universitätsklinikum, zum Beispiel der Onkologie, der Hals-Nasen-Ohren Klinik, der Augenklinik und der Neurochirurgie. Die Platzierung des Arzneistoffträgers direkt am Wirkort, zum Beispiel am Auge oder im Ohr, ist dabei eine Möglichkeit. Mit im menschlichen Körper abbaubaren Polymeren können dort Wirkstoffe über Tage, Wochen oder Monate freigesetzt werden. Eine andere Möglichkeit ist die Herstellung von Nanopartikeln, welche sich von selbst am Wirkort anreichern und dort gezielt den Wirkstoff freisetzen. Mäder spricht dann gerne von Wirkstoff-Taxis.
Für verbesserte Freisetzungssysteme gibt es zahlreiche Einsatzmöglichkeiten. Neben den Polymer-Kontaktlinsen entwickelt Mäder auch ein Vlies, das nach Hirn-Operationen eingesetzt werden könnte. Dafür müssen die verwendeten Polymere jedoch erheblich länger stabil bleiben als diejenigen für die Augen. Beladen werden sollen sie mit einem Wirkstoff, der die Nervenzellen schützt. „Momentan wird er gespritzt. Dabei muss die Dosis jedoch geringgehalten werden, weil sich das Mittel auch schnell auf das Herz auswirkt“, erklärt Mäder.
Arzneistoffe nur lokal anzuwenden ist freilich nicht die einzige Möglichkeit, eine zielgerichtete Wirkung zu erreichen. „Der Trend geht immer mehr zur individualisierten Medizin“, sagt Mäder. Manche Medikamente sind nur wirksam, wenn bei Patienten ein bestimmter Rezeptor ausgebildet ist. Nicht selten kommt es vor, dass sich erst nach der Zulassung eines neuen Medikaments herausstellt, warum es bei manchen Menschen wirkt, bei anderen nicht. Die zentrale Frage auf dem Weg zu möglichst spezifischen Wirkstoffen, sagt Mäder, sei daher: „Wo möchte ich überhaupt angreifen, wo möchte ich etwas verändern?“ Die Antwort: So wie ein Puzzleteil in das andere greift, so muss das Wirkstoffmolekül in die krankheitsauslösende molekulare Struktur – beispielsweise ein Enzym – passen. Aber es klingt einfacher, als es ist, einen passgenauen neuen Wirkstoff zu entwerfen. Enorm viel Grundlagenforschung ist nötig, wie sie beispielsweise an der Universität Halle betrieben wird.
Das Institut für Pharmazie in Halle ist eines der größten deutschlandweit. 17 Arbeitsgruppen arbeiten hier an vielen verschiedenen Themen. Einige beschäftigen sich nur damit, wie die mikroskopisch kleinen Strukturen im Körper aussehen, an denen ein Wirkstoff andocken könnte. Andere entwerfen am Computer die dazu passenden chemischen Strukturen und testen dann im Labor, ob sie sich überhaupt herstellen lassen. Auch die Natur bietet immer wieder neue Lösungen: In einer Arbeitsgruppe werden beispielsweise traditionelle afrikanische Heilpflanzen erforscht, andere suchen in Bakterien nach neuen Substanzen. Pflanzen und Bakterien entwickeln oft sehr spezifische Abwehrmechanismen gegen Krankheitserreger, die auch beim Menschen angewendet werden können.
Doch egal, wie ein Wirkstoffmolekül gefunden wird: Damit daraus ein zielsicheres Medikament werden kann, muss von Anfang an die Anwendung mitgedacht werden, so Mäder. Die Moleküle müssen mit den chemischen Bedingungen im Körper zurechtkommen. „Früher wurde in der Pharmaindustrie vor allem auf möglichst gute Wirksamkeit am Rezeptor optimiert.“ Dann könne es aber passieren, dass die hoch spezifischen Strukturen sich in der Praxis als unbrauchbar herausstellen, weil sie zu wenig löslich sind und den Wirkort nie erreichen. „Wenn das Molekül wie ein Backstein ist, wird es schwierig“, so der Pharmazeut.
Mittlerweile ist die sogenannte Bioverfügbarkeit bei der Entwicklung neuer Medikamente mehr in den Fokus gerückt. Das Biopharmazeutische Klassifizierungssystem teilt Arzneistoffe in vier Klassen ein, je nachdem wie gut diese löslich sind und die Zellmembran passieren. Das ist auch ein wichtiges Instrument bei der Zulassung sogenannter Generika. Denn diese enthalten zwar denselben Wirkstoff wie ein Originalpräparat, können aber andere Hilfsstoffe beinhalten. Als Spezialist für eben diese betont Mäder, dass man bei der Beurteilung der Gleichwertigkeit von Generika mit dem Original und der Vergleichbarkeit von Generika untereinander vorsichtig sein muss. Denn Hilfsstoffe beeinflussen nicht nur die Löslichkeit, sondern auch, wie schnell oder lange ein Mittel wirkt. Laut der sogenannten aut-idem-Regelung der gesetzlichen Krankenkassen sollen Apotheken – sofern der Arzt nicht explizit ein bestimmtes Arzneimittel verschreibt – ein äquivalentes Generikum von einem günstigen Vertragshersteller ausgeben. „Mittlerweile sind mehrere Medikamente durch den Gemeinsamen Bundesausschuss von dem Austausch ausgeschlossen worden“, sagt Mäder. In dem Ausschuss entscheiden Ärzte- zusammen mit Krankenkassen- und Krankenhausvertretern über kassenärztliche Leistungen.
Die Herstellung eines neuen Arzneimittels ist komplex, betont Mäder. Die Entwicklung dauert oft sehr lange, so dass die Neuentwicklung nur kurze Zeit durch den Patentschutz vor Nachahmung geschützt ist. Nur einer von tausenden in Laboren hergestellten Wirkstoffen kommt wirklich auf den Markt. Die am Computer hergestellten Strukturen stellen sich oft als in der Praxis nicht anwendbar heraus. Bei Pflanzenextrakten ist es oft schwierig, die wirksamen Moleküle oder Molekülmischungen zwischen den zahlreichen in einer Pflanze vorhandenen Stoffen zu finden und zu standardisieren.
Viele Ideen werden nicht weiterverfolgt, weil das Geld fehlt. Die für die Zulassung eines Wirkstoffs nötigen präklinischen und klinischen Studien kosten Millionen, vom Wirkstoff zum Medikament dauert es normalerweise mindestens zehn Jahre. „Das schlimmste, was passieren kann, ist wenn das Medikament in einer der letzten Phasen stirbt“, sagt Mäder. Das Ziel der Pharmaindustrie sei es schließlich, Geld zu verdienen. Das sei auch der Grund, warum finanziell wenig lukrative Forschung, wie die Suche nach neuen Antibiotika, oft nur noch an Universitäten und wissenschaftlichen Instituten vor allem mit öffentlichen Mitteln betrieben werde. Im Rahmen einer von der DFG geförderten Forschergruppe mit Wissenschaftlern aus Deutschland, Israel und Palästina hat Mäders Arbeitsgruppe beispielsweise einen Malaria-Wirkstoff so verarbeitet, dass er wesentlich besser über den Darm in den Körper aufgenommen werden kann und hochwirksam ist. Ein weiteres Forschungsergebnis hat der Institutsdirektor zusammen mit Kollegen vor wenigen Monaten zum Patent angemeldet: flexible Stäbchen aus ebenfalls bioabbaubaren Polymeren mit einem Antibiotikum. Sie sollen zur Parodontose-Behandlung in die Zahnfleischtasche geschoben werden. Durch die lokale Anwendung könnten die unerwünschten Wirkungen von Antibiotika auf den gesamten Körper – wie Durchfall und Hautreaktionen – vermieden werden. In naher Zukunft sind klinische Tests geplant.
Der große Vorteil der Forschung in Mäders Arbeitsgruppe ist, dass sie viel mit bereits bekannten Wirkstoffen und oft auch mit handelsüblichen Hilfsstoffen arbeitet. So können die Ergebnisse relativ schnell zum Einsatz kommen und es dauert oft weniger als zehn Jahre, bis die Entwicklungen marktreif sind. Die Parodontosestäbchen mit Antibiotika-Komplex und die Kontaktlinsen mit Anti-Pilz-Wirkstoff könnten also schon bald den Patienten helfen.
Prof. Dr. Karsten Mäder
Institut für Pharmazie
Tel. +49 345 55-25167
Mail: karsten.maeder@pharmazie.uni-halle.de
Weitere Artikel zum Thema
Resistente Keime im Visier
Neuartige Wirkstoffe helfen gegen gefährliche Bakterien, denen herkömmliche Antibiotika nichts mehr anhaben können. Entwickelt werden sie im Team von Prof. Dr. Andreas Hilgeroth. Artikel lesen
Enzym-Klebstoff gegen Krebs
René Wartner, Andreas Simon und Marcus Böhme haben eine Technologie zur punktgenauen Bekämpfung von Tumoren entwickelt. Ihr Enzym-Klebstoff soll es ermöglichen, Toxine an Antikörper zu binden und gezielt zu Krebszellen zu transportieren. Das Konzept wollen die drei Biochemiker als Unternehmer vermarkten. Artikel lesen